УДК: 619:615.038
Петрова О.В., Климов П.В.
В данной статье представлены результаты изучения фармакокинетики дексмедетомидина при внутримышечном введении собакам ветеринарных лекарственных препаратов Дексодия и Дексдомитор®. Определение дексмедетомидина в плазме крови животных проводили методом высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием. Полученные фармакологические параметры были обработаны статистически и подвергнуты сравнительному анализу на соответствие критериям биоэквивалентности. Было установлено, что препараты Дексодия и Дексдомитор® являются биоэквивалентыми и время наступления, продолжительность терапевтического действия будут идентичны.
Ключевые слова: дексмедетомидин, Дексодия, Дексдомитор®, селективный агонист α2-адренорецепторов, биоэквивалентность
Введение
В последние годы агонист α2-адренергических рецепторов дексмедетомидин пользуется большим спросом у клиницистов, чем другие лекарственные препараты для седации, поскольку, воздействуя на голубое пятно головного мозга, препарат вызывает естественный сон, не оказывая существенного угнетающего влияния на функцию дыхания и имеет большую управляемость, характеризуется относительно быстрым наступлением и прекращением эффекта, животные быстрее восстанавливаются, сокращается время пребывания в ОРИТ [1].
Дексмедетомидин представляет собой производное имидазола и является активным декстроизомером медетомидина, проявляющим специфический и селективный α2-адренорецепторный агонизм. Механизм действия и отдельные фармакологические эффекты дексмедетомидина несколько отличается от применяемых в настоящее время седативных средств. Активация рецепторов в головном и спинном мозге подавляет возбуждение нейронов, вызывая гипотензию, брадикардию, седативный эффект и анальгезию. Ответы на активацию рецепторов в других органах и тканях включают снижение слюноотделения, снижение секреции и перистальтики кишечника; сокращение сосудистой и другой гладкой мускулатуры; ингибирование высвобождения ренина, усиление клубочковой фильтрации и усиление секреции натрия и воды в почках; снижение внутриглазного давления; и снижение высвобождения инсулина. Анксиолизис и седация связаны главным образом со стимуляцией постсинаптических альфа2-адренорецепторов голубого пятна ствола головного мозга. Анальгетический эффект опосредован в первую очередь активацией пресинаптических норадренэргических альфа2-рецепторов дорсальных рогов спинного мозга. Активация альфа2-адренорецепторов медуллярного вазомоторного центра приводит к снижению выброса норадреналина и снижению центральной симпатической активности, что проявляется урежением сердечного ритма и снижением кровяного давления. В сочетании эти эффекты вызывают анальгезию, седативный эффект и анксиолиз [12-14].
В данной работе мы поставили цель изучить фармакокинетику дексмедетомидина in vivo на собаках для демонстрации биоэквивалентности лекарственных препаратов в форме растворов для инъекций: Дексодия и Дексдомитор®.
Материалы и методы
Исследование было выполнено на 12 молодых, клинически здоровых собаках обоего пола. Животных содержали в вольерах по 2 особи, рацион состоял из сухого коммерческого корма для взрослых собак по установленным суточным нормам. После 7 дневного карантина по принципу аналогов животные были разделены на 2 группы по 6 голов. Непосредственно перед введением препаратов у собак проводили клинический осмотр, измерение температуры, частоты пульса и дыхания. Объектом изучения являлись разрабатываемый воспроизведенный препарат Дексодия и зарегистрированный референтный препарат Дексдомитор®, которые в качестве действующего вещества содержат дексмедетомидина гидрохлорид по 0,5 мг в 1 мл раствора для инъекций. Препараты вводили собакам однократно в дозе 0,8 мл/10 кг (или 40 мкг/кг массы по ДВ) массы тела внутримышечно. Пробы крови отбирали из доступных для взятия поверхностных вен предплечья во временные точки - 0 ч (до введения препарата); а затем через 2 мин, 5 мин, 10 мин, 15 мин, 30 мин, 45 мин, 1 час, 1,5 часа, 2 часа, 4 часа, 6 часов после применения. Плазму крови отделяли после центрифугирования в режиме 3500 об/мин в течение 20 - 25 мин и до анализа хранили в замороженном виде в пробирках Eppendorf при - 70 ºС. Аналитическую работу по установлению фармакокинетических параметров и биоэквивалентности препаратов, разработку методики количественного определения дексмедетомидина выполняли при содействии ФГАОУ ВО Первый МГМУ им. И. М. Сеченова Минздрава России. Концентрации дексмедетомидина определяли валидированным аналитическим методом высокоэффективной жидкостной хроматографии с масс-спектрометрией (HPLC-MS). Полная валидация биоаналитического метода определения дексмедетомидина в плазме крови проведена в соответствии с рекомендациями EMA (Guideline on bioanalytical method validation, EMEA/CHMP/EWP/192217/2009 Rev. 1 Corr. 2, 21.07.2011) и стандартными процедурами лаборатории. Исследования были проведены с учетом Принципов надлежащей лабораторной практики (GLP; Principles of Good Laboratory Practice), Организации экономического сотрудничества и развития (OECD; Organization for Economic Cooperation and Development) и Руководства по экспертизе лекарственных средств под редакцией д. мед. Н., профессора А. Н. Миронова (Издание ФГБУ «НЦЭСМП», 2019) и Правилами ЕАЭС №85 от 3 ноября 2016 г [2-11].
В аналитическом этапе работы использовался жидкостной хроматограф высокого давления - Waters Acquity I class UPLC (США) с тандемным квадрупольным масс-спектрометрическим детектором Water TQ-S micro (США). Исходные хромато-масс-спектрометрические данные обрабатывали с использованием программного комплекса Target Lynx Application Manager фирмы Waters Corporation, США. Статистическую обработку полученных данных осуществляли с использованием программных комплексов Microsoft Excel 2013 фирмы Microsoft Corporation, США и Minitab 16 фирмы Minitab Inc., Великобритания. Иллюстрированный материал был представлен с использованием программных комплексов Microsoft Excel 2013 фирмы Microsoft Corporation, США; Minitab 16 фирмы Minitab Inc., Великобритания и MassHunter фирмы Agilent Technologies, США. Для определения вещества были соблюдены следующие условия:
· Аналитическая колонка Acquity UPLC BEH C18 (2,1 × 50 мм; 1,7 мкм) фирмы Waters Corporation, США
· Преданалитическая колонка Acquity UPLC BEH C18 (2,1 × 5 мм; 1,7 мкм) фирмы Waters Corporation, США
· Термостатирование аналитической колонки 40 ºС
· Температура в автосаммплере 10 ºС
· Скорость потока подвижной фазы 0,30 мл/мин
· Состав подвижной фазы Фаза А - 0,01% раствор муравьиной кислоты в воде; Фаза B - 100 % ацетонитрил для хроматографии
· Программа градиентного элюирования
| Время, мин | Кол-во фазы А, % | Кол-во фазы B, % |
| 0.00 | 99 | 1 |
| 1.60 | 1 | 99 |
| 2.10 | 1 | 99 |
| 2.20 | 99 | 1 |
| 2.50 | 99 | 1 |
· Объем вводимой пробы 5 мкл
· Общее время анализа 2,5 мин
Параметры тандемного квадрупольного масс-спектрометрического детектора
· Тип ионизации Ионизация положительными ионами
· Source Temperature 150ºС
· Desolvation Temperature 350 ºС
· Cone Gas Flow Rate 25 л/час
· Desolvation Gas Flow Rate 650 л/час
· Transition Dwell Time 0,05 сек
· Capillary Voltage 4,0 кВ
· Mode of Analysis MRM, positive ion
При валидации аналитической методики использовали стандарт вещества фармакопейного качества - USP Standard, США, с активностью 99,89%.
Калибровочные кривые строили на основании результатов анализа проб плазмы крови интактных животных, к которым были добавлены известные количества дексмедетомидина. Подготовку объектов исследования (биологических образцов) к инструментальному анализу осуществляли путем осаждения белков плазмы крови органическим растворителем без последующей процедуры экстракции исследуемого аналита. Анализ биологических образцов, полученных от субъектов исследования, проводили в соответствии с требованиями разработанной и валидированной методики количественного определения дексмедетомидина в плазме крови собак. Диапазон калибровки для дексмедетомидина составил 0.20 – 30.00 нг/мл. В качестве основных переменных для оценки фармакологических параметров и биоэквивалентности были выбраны показатели AUC0-t (площадь под кривой от 0 до 6 часов), AUC0-∞ (площадь под кривой от 0 до бесконечности), Cmax (максимальное значение концентрации препарата в крови). С помощью дисперсионного анализа (ANOVA; параметрический метод) оценивали различия между средними значениями фармакокинетических параметров при 5% уровне значимости.
Полученная с помощью дисперсионного анализа оценка остаточной вариации использовалась для расчета доверительных интервалов для отношений средних значений соответствующих основных параметров биоэквивалентности: AUC0-t (площадь под кривой от 0 до 6 часов), AUC0-∞ (площадь под кривой от 0 до бесконечности) и Сmax (максимальное значение концентрации препарата в крови). Вычисляли параметрические двухсторонние 90% доверительные интервалы для отношений соответствующих средних значений, изучаемых параметров фармакокинетики для исследуемого препарата Дексодия и препарата сравнения. Согласно правилам, статистическая проверка биоэквивалентности состояла в статистическом сравнении средних значений параметров, выбранных в качестве показателей биоэквивалентности (AUC0-t и Сmax).
Результаты:
По результатам аналитической работы был построен график фармакологического профиля для двух препаратов:
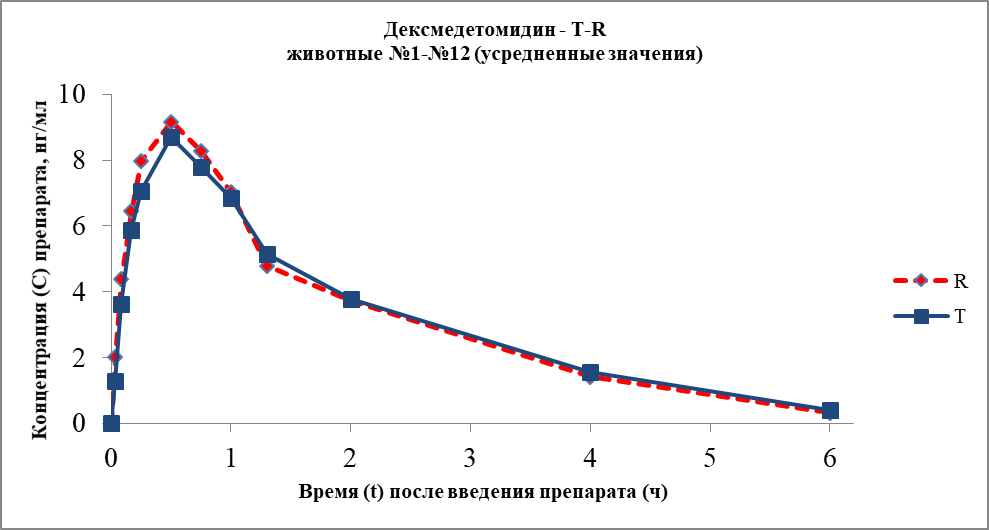
Рисунок 1 График усредненных фармакокинетических профилей (в линейных координатах) для дексмедетомидина, Т- профиль для препарата Дексодия и R –профиль по препарату Дексдомитор
Основные фармакологические параметры количественно показаны в таблице 1.
Таблица 1. Фармакокинетические параметры дексмедетомидина, для препаратов Дексодия (T) и Дексдомитор (R), рассчитанные по усредненным данным
| Препарат | Параметры |
T1/2 ч |
Tmax, ч |
Cmax, нг/мл |
AUC0-t, нг/мл´ч | AUC0-∞ нг/мл´ч |
MRT, ч |
Kel (ч-1) |
|
Дексодия |
Среднее арифметическое | 1.32 | 0.54 | 8.75 | 19.30 | 20.61 | 1.69 | 0.5597 |
| Стандартное отклонение | 0.40 | 0.10 | 0.78 | 2.95 | 3.65 | 0.26 | 0.1440 | |
|
CV, % |
30.4 | 18.8 | 8.9 | 15.3 | 17.7 | 15.2 | 25.7 | |
| Дексдомитор | Среднее арифметическое | 1.23 | 0.46 | 9.20 | 19.02 | 20.34 | 1.55 | 0.5892 |
| Стандартное отклонение | 0.29 | 0.10 | 0.76 | 3.57 | 3.82 | 0.32 | 0.1432 | |
|
CV, % |
23.8 | 22.3 | 8.2 | 18.8 | 18.8 | 20.5 | 24.3 | |
Сравнительный анализ основных фармакокинетических параметров для исследуемого препарата Дексодия (разработчик - Innorium SA) и препарата Дексдомитор® (разработчик - Орион Корпорейшн) показал, что изучаемые препараты поступают в системный кровоток из места инъекции с одинаковой скоростью. Время достижения максимальной концентрации для дексмедетомидина (Tmax) составило в среднем для Дексодии – 0,54±0,10 и для Дексдомитора – 0,46±0,10 ч. Приведенные данные свидетельствуют, что по времени достижения максимальной концентрации между изучаемыми лекарственными препаратами достоверных различий не обнаружено. При этом средняя максимальная концентрация дексмедетомидина, определяемая в плазме крови собак (Cmax), составила для Дексодии – 8,75±0,78 нг/мл и для Дексдомитора – 9,20±0,76 нг/мл.
Для логарифмически преобразованных значений геометрического среднего, вычисленного для индивидуальных отношений исходных значений параметров AUC0-t препарата Дексодия, разработанного Innorium SA (Швейцария) к AUC0-t препарата сравнения (R) Дексдомитор®, разработанного Орион Корпорейшн (Финляндия) 90 % доверительные интервалы для дексмедетомидина, составили следующие значения: 81,54 % (нижняя граница) и 117,84 % (верхняя граница), соответственно, для Сmax доверительный интервал составил 95,93 % (нижняя граница) и 115,19 % (верхняя граница), для AUC0-∞ доверительный интервал составил 81,55 % (нижняя граница) и 118,96 % (верхняя граница).
Вывод:
На основании полученных данных и при оценке параметров относительной биологической доступности, установленных методическими рекомендациями, 90% доверительные интервалы для логарифмически преобразованных значений для величин Сmax, AUC0-t и AUC0-∞ не выходят за пределы верхней и нижней границ и целиком принадлежат области внутри этих границ (80.00% - 125.00%), что говорит о биоэквивалентности исследуемого препарата Дексодия (Innorium SA/Иннориум СА) и препарата сравнения (R) Дексдомитор®, (Орион Корпорейшн), по активному компоненту – дексмедетомидин. Исследование биоэквивалентности показало, что при применении препарата Дексодия время наступления, глубина и продолжительность клинических эффектов будут сопоставимы с оригинальным, сравниваемым препаратом Дексдомитор®
Литература
1. Еременко А.А., Зюляева Т.П., Розина Н.А., Чернова Е.В., Сорокина Л.С. Эффективность и безопасность применения дексмедетомидина для послеоперационной седации кардиохирургических пациентов. Кардиология и сердечно-сосудистая хирургия. 2020;13(3):199‑206.
2. Решение Совета Евразийской экономической комиссии № 85 от 03 ноября 2016 года «Об утверждении Правил проведения исследований биоэквивалентности лекарственных препаратов в рамках Евразийского экономического союза».
2. Руководством по экспертизе лекарственных средств под редакцией д. мед. Н., профессора А. Н. Миронова (Издание ФГБУ «НЦЭСМП», 2019).
3. In vivo bioequivalence guidances (U.S. Pharmacopeia 24"NF 19, National Formu-lary, Supplement 1090, 3000).
4. Бондарева И.Б., Буданов С.В., Бунятян Н.Д. и соавт. Оценка биоэквивалентности лекарственных средств. Методические указания. Москва: ФГУ «НЦ ЭСМП»; 2008, 32 с.
5. Руководство для регуляторных органов по лицензированию генерических лекарственных средств (A Manual for Drug Regulatory Authorities. Marketing Authorization of Pharmaceutical Products with Special Reference to Multisource (Generic) Products. ВОЗ, 1999.
6. Note for Guidance on the Investigation of Bioavailability and Bioequivalence. - The European Agency for the Evaluation of Medical Products, Committee for Proprietary Medicinal Products, London, 2010.
7. Statistical Approaches to Establishing Bioequivalence. - U.S. Department of Health and Human Services Food and Drug Administration, Center for Drug Evaluation and Research, January, 3001.
8. Waiver of in vivo Bioavailability and Bioequivalence Studies for Immediate-Release Solid Oral Dosage Forms Based on a Biopharmaceutics Classification System. - U.S. Department of Health and Human Services Food and Drug Administration, Center for Drug Evaluation and Research, August 3000.
9. Bioequivalence Assessment. Methods and Applications, Ed. Steinijans V. W. Int. J. Clin. Pharmacol. Ther. and Toxicol., Vol. 30 (Suppl. 1), 1992, pp. 1-66.
10. Investigation of Bioavailability and Bioequivalence - Commission of the European Communities, III/54/89-EN, December 1991, pp. 1-20.
11. Hauschke D., Steinijans V.W., Diletti E., Burke M., Sample Size Determination for Bioequivalence Assessment Using a Multiplicative Model. J. Pharmacokin. Biopharm. 1992, Vol. 20, p. 557 – 561.
12. Lemke, K.A. (2004). Perioperative use of selectivealpha-2 agonists and antagonists in smallanimals. Can. Vet. J. 45:475-480.
13. Mizobe T., Maze M. a2-Adrenoceptor agonists and anesthesia. International Anesthesiology Clinics: Vol 33. Issue 1. ppg 81-102, 1995.
14. Ralph Gertler, H. Cleighton Brown, Donald H. Mitchell, and Erin N. Silvius, Dexmedetomidine: a novel sedative-analgesic agent. Proc (Bayl Univ Med Cent). 2001 Jan; 14(1): 13–21. doi: 10.1080/08998280.2001.11927725.



